英國UKCA認證需要注意哪些問題
- 時間:2021-11-18作者:上海沙格醫療科技有限公司武漢分公司瀏覽:424
上海沙格醫療科技有限公司武漢分公司專注于IVDR,CE認證,MDR,QSR820驗廠,英國UKCA認證等
詞條
詞條說明
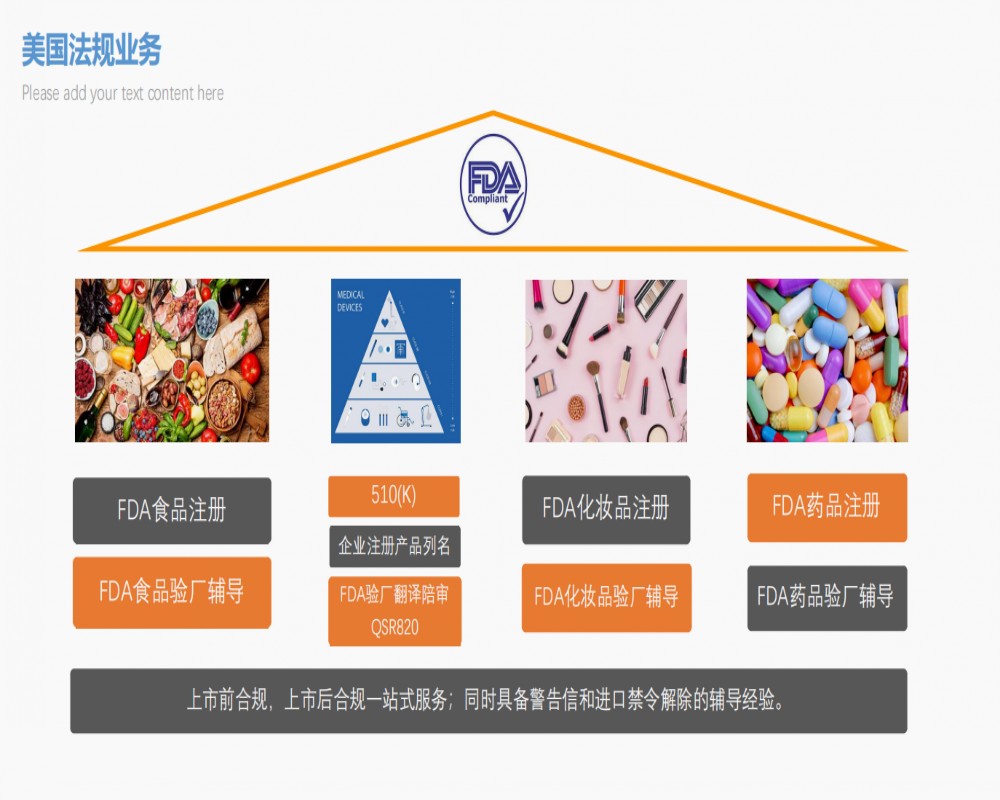
FDA驗廠的法規背景:美國醫療器械監督管理局(FDA)是負責醫療器械管理的**機構。其根據各相關法律授權而**的各類法規性的文件編號為21CFRxxxx(xxxx為阿拉伯數字)。其中21CFR820是FDA根據法案*501,502,510,513,514,515,518,519,520,522,701,704,801,803條款的授權而**的規范醫療器械企業質量體系要求的法規,即Quality S
FDA驗廠即工廠檢查,FDA屬下的CDRH(器材與放射性健康中心)是職業承擔醫療設備企業管理方法的**部門,其依據FDA的受權,分配檢查員到各企業開展工廠檢查。驗廠抽樣檢查標準 --依據法律法規,對未免除QSR 820的設備的生產制造企業,開展常規檢查;(大部分狀況) --II類器材或者有510(K)申請注冊的用具的企業,非常*被抽中; --為海外大企業做OEM的企業; --商品在美國銷售市場產
申請激光產品FDA需要提供以下資料:1.產品說明書2.激光測試報告3.激光路徑圖4.生產工廠品質品質流程5.整機測試, 如耐久性測試, 振動測試, 高溫高濕測試等,6.樣品1-2件7.激光通路圖8.標簽電子檔9.品保方面的檢測流程圖; 生產,安裝流程圖,從來料到入倉的整個過程。10.整機測試,如耐久性測試,振動測試,高溫高濕測試等。五、醫療器械FDA認證,包括:廠家在FDA注冊、產品的FDA登記、
ISO13485認證分為初次認證、年度監督檢查和復評認證等,具體如下:一、初次認證1、企業將填寫好的《ISO13485認證分申請表》,認證中心收到申請認證材料后,會對文件進行初審,符合要求后發放《受理通知書》。2、現場檢查一周前將檢查組組成和檢查計劃正式報企業確認。3、現場檢查按環境標志產品**措施指南的要求和相對應的環境標志產品認證技術要求進行。4、檢查組根據企業申請材料、現場檢查情況、產品環境
聯系方式 聯系我時,請告知來自八方資源網!
公司名: 上海沙格醫療科技有限公司武漢分公司
聯系人: 蔣小姐
電 話: 17717017570
手 機: 18007141921
微 信: 18007141921
地 址: 湖北武漢江漢區新華西路武漢菱角湖萬達廣場A區A.幢A3單元12層5號
郵 編:
相關推薦
相關閱讀
1、本信息由八方資源網用戶發布,八方資源網不介入任何交易過程,請自行甄別其真實性及合法性;
2、跟進信息之前,請仔細核驗對方資質,所有預付定金或付款至個人賬戶的行為,均存在詐騙風險,請提高警惕!
- 聯系方式
公司名: 上海沙格醫療科技有限公司武漢分公司
聯系人: 蔣小姐
手 機: 18007141921
電 話: 17717017570
地 址: 湖北武漢江漢區新華西路武漢菱角湖萬達廣場A區A.幢A3單元12層5號
郵 編:
- 相關企業
- 北京同基偉業管理咨詢有限公司
- 合肥傲宇認證有限公司
- 鎮江九州管理咨詢有限公司
- 中包測試技術(廣東)有限公司
- 上海序亭通信科技有限公司
- 廣東啟智企業服務有限公司
- 浙江三洲檢測認證有限公司
- 深圳市中檢聯標技術服務有限公司
- 蘇州天標檢測技術有限公司
- 臺州鑫程認證有限公司
- 商家產品系列
- 集團電話維修
- 技術轉讓
- 家用電器回收
- 手板模型
- 臺式機回收
- 包裝設計
- 保險服務
- 筆記本回收
- 賓館服務
- 秘書服務
- 打印機維修
- 檔案管理
- 電腦租賃
- 電子商務
- 管理培訓
- 管理咨詢
- 廣告策劃
- 廣告代理
- 廣告發布
- 廣告設計
- 國內貨運運輸
- 國內勞務派遣
- 海外公司注冊
- 戶口咨詢
- 會計服務
- 活動策劃
- 平面設計
- 企業日常服務
- 企業形象設計
- 簽證咨詢
- 產品推薦
- 資訊推薦

豐田汽車電子設備TSC7000G可靠性檢測-專注汽車零部件DV試驗
¥118888.00



¥88.00